疫情对生活的影响是方方面面的,生命科学领域的研究工作,同样也受到了疫情的影响。
此前,针对新冠疫情导致的非人灵长类动物(non-human primate, NHP)短缺,美国食品药品监督管理局(Food and Drug Administration, FDA)向新药研发和研究人员发布新建议,敦促他们在一般毒理学研究中考虑使用NHP的替代品。
这项FDA文件是近年来开始出现的减少临床前研究中使用NHP这一趋势的最新例证。
NHP通常被认为是评估免疫刺激性抗体和相关产品毒性的金标准。因为与其他临床前动物模型相比,NHP与人类的基因同源性最高。
用体外试验替代NHP对只发生在体内的细胞非自主毒性作用,会有不能真实反应的风险,例如不能真实反应细胞因子释放综合征 (cytokine release syndrome, CRS) 的机制。
另一方面来说,大多数体内临床前模型(如啮齿动物、犬和兔)缺乏人特异性药物靶点,转化价值也非常低。
JAX hu-PBMC-NSG小鼠是移植有提前表征的人外周血单核细胞 (human peripheral blood mononuclear cell, PBMC) 的NSG™免疫缺陷小鼠,旨在用来在更小范围内重现具有功能性的人免疫系统。经移植的小鼠已从简单的“啮齿动物模型”变成了与转化相关的体内分析平台。

在CRS评价研究中,hu-PBMC-NSG小鼠的转化价值尤为突出。例如,与目前大多数药物开发人员可用的临床前检测不同,hu-PBMC-NSG平台允许检测人特异性激活分子(如CD28超激动剂TGN1412)的毒性(图1)。
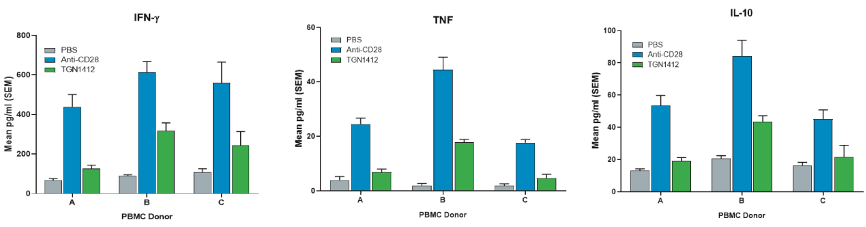
(图1:hu-PBMC-NSG小鼠被注射了溶剂 (PBS) 或两种不同的CD28/CD抗体28和TGN1214超激动剂。直方图表示所示化合物诱导的促炎细胞因子的数量。横轴表示不同的供体(A、B 和 C)。值得注意的是,T细胞超激动剂CD28抗体 和TGN1412对免疫细胞的过度活化程度因供体而异,反映了人类群体中免疫应答的多样性。)
不同于NHP,研究人员可以在hu-PBMC-NSG小鼠体内植入肿瘤,以评估药物靶点作用引起的免疫毒性。当分析双特异性抗体(如靶向CD3的双特异性抗体)的CRS可能性时,这一特色至关重要(图2)。因为评估此类抗体的活性和潜在毒性时,需要两个抗体臂分别作用于其抗原靶标。
事实上,可以认为hu-PBMC-NSG小鼠比NHP更适合于免疫肿瘤药物的毒理学评价,因为研究人员可以在目标肿瘤存在的情况下评价免疫毒性。
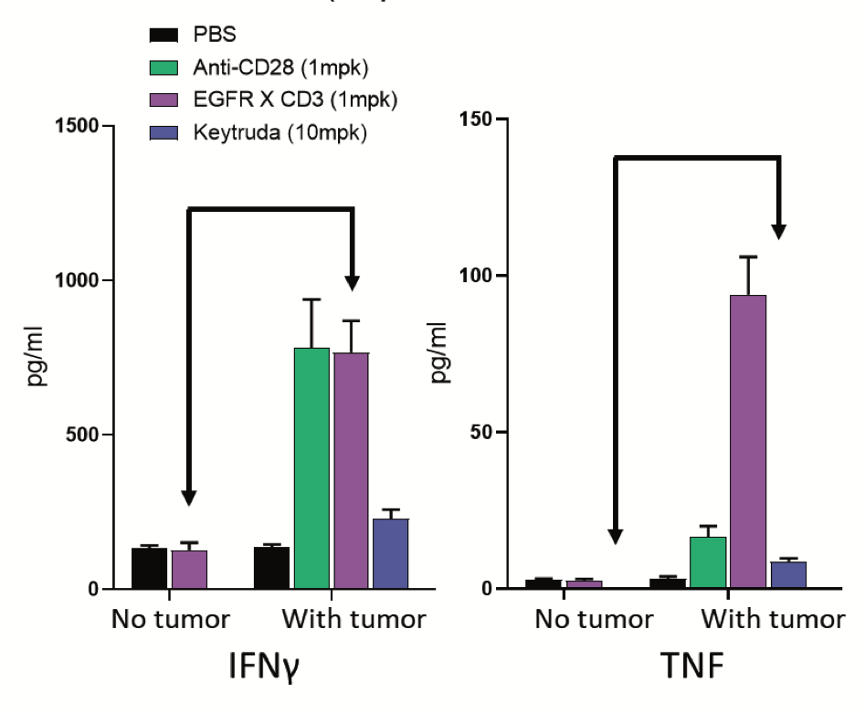
(图2:移植或未移植MDA-MB-231的hu-PBMC-NSG小鼠分别用PBS(溶剂)、CD28抗体(阳性对照)、Keytruda(阴性对照)或针对EGFR的CD3双特异性抗体进行处理。仅肿瘤携带小鼠表现出双特异性抗体介导的免疫毒性(如箭头所示)
hu-PBMC-NSG小鼠的另一个用途是预测联合用药的CRS发生可能性。
由于成本、伦理和实际考虑等因素限制了NHP在多种药物联合治疗测试中的使用,而hu-PBMC-NSG小鼠可为研究人员提供转化相关结果,用以分析特定药物联合治疗的潜在毒性和疗效。
图3为靶向EGFR的CD3双特异抗体与Keytruda联合治疗的实例。结果表明,联合用药不会增加治疗毒性,但也不会产生任何疗效优势。
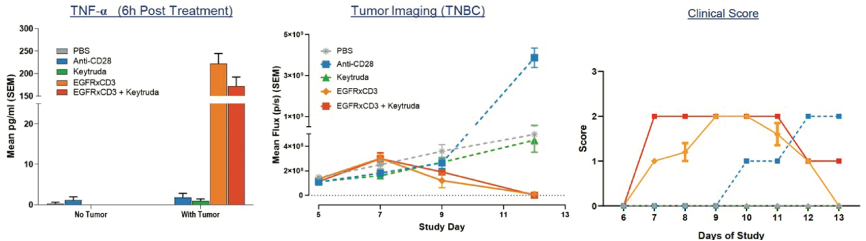
(图3:CD3双特异抗体与Keytruda联合治疗不会导致促炎细胞因子释放的绝对增加(左图)。然而,联合用药会加速临床评分症状(右图),这说明细胞因子的释放加快,进而导致毒性增强。有趣的是,联合用药并没有增加疗效(中图)。)
以hu-PBMC-NSG模型转化相关分析平台,评估CAR T疗法的免疫毒性
hu-PBMC-NSG对双特异性抗体的反应也反映在CAR T细胞疗法中,这一点尤为重要,因为大量患者会出现CRS症状的严重毒性反应。传统的体外检测不能模拟导致患者下游器官和神经系统毒性的全身免疫反应,而这些毒性免疫分析又是确定治疗方法真正疗效和安全性的关键特征。
在一项16天内完成的试验中,人源化小鼠平台重点测量单个患者的反应,其中CAR T疗效和CRS可以利用单独表征的PBMC供体一起测量,从而模拟临床环境中的患者反应(图4)。
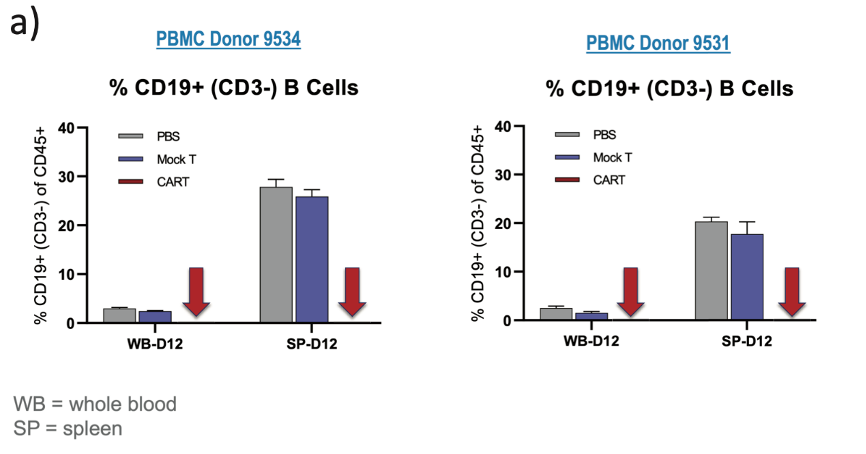
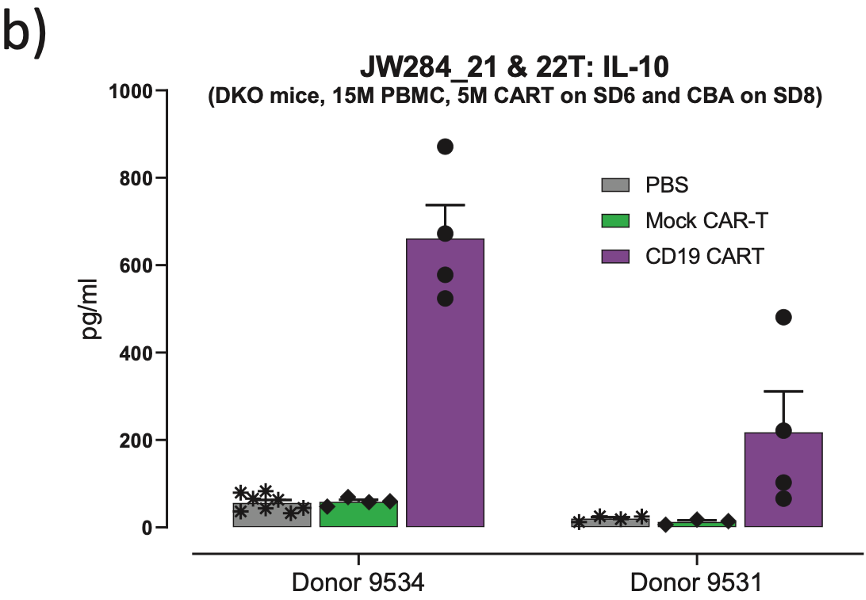
(图4:不同供体表现出不同的活性/毒性比率。当比较图4a中两个单独的供体时,在两项研究中,模拟CAR T疗法对血液或脾脏中的B细胞比率均没有影响。代表CAR T的箭头指向100%去除PBMC衍生的正常CD19+ B细胞,表明对两个供体的疗效和反应是完成的。)
(图4b显示了两个供体间相差较大的细胞因子反应(本例展示 IL-10),表明供体9531可能从CAR T疗法中获益,而没有广泛的毒性。WB:全血;SP:脾脏))
体内模型相对于体外方法的一个显著优势是:可以模拟导致复杂表型(如临床表现和体重下降)的复杂多器官反应。
例如,在检查前两张图中相同研究的体重数据时,我们看到体重的显著差异与细胞因子水平一致。这些数据支持在人源化平台的体内试验中评估CAR T的整体价值,以检查细胞因子反应对小鼠健康的整体影响,而这是体外或非人源化平台无法实现的。
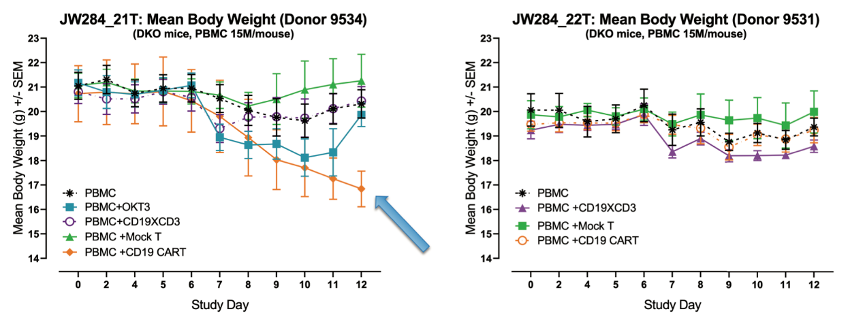
(图5:来自供体9534(左)或9531(右)的hu-PBMC-NSG小鼠的平均体重。每种疗法的符号显示在各图左下角。值得注意的是,植入供体9534的PBMC细胞并且采用CD19 CAR T疗法的小鼠显示出CRS导致的痛苦迹象(箭头))
人源化系统
使用人源化系统可将功能完善的人免疫系统与人源靶点结合起来,提供更具预测性的数据,更好地反映在一个独特的人类群体中所观测到的多样性和差异性。
有关使用人源化小鼠平台进行抗体药代动力学、疗效和毒性研究的更多信息,请访问以下资源或联系杰克森实验室技术支持(micetech@jax.org.cn, 400-001-2626):

