免疫系统人源化小鼠是研究临床相关问题的重要载体,为转化医学提供了不可多得的研究平台。 NSG小鼠是适用于各类细胞、组织移植的重度免疫缺陷鼠。在这篇文章里,我们将向大家介绍人源化NSG小鼠在构建临床相关的GVL模型上的应用。
背景介绍
急性髓系白血病(AML)是成人中最常见的急性白血病,在我国,AML的发病率约为1.62/10万。异体造血干细胞移植(alloSCT)依靠其移植物抗白血病(GVL)效应,是AML的有效巩固疗法。
Allogeneic peripheral-blood stem-cell transplantati on (alloSCT)
Warren D. Shlomchik, Nat Rev Immunol. 2007
尽管如此,白血球免疫逃逸导致GVL失败,从而引起AML复发仍然是大部分病人移植后死亡的主要原因,患者五年生存率仅为28%。目前为止,人们对白血球免疫逃逸的机制知之甚少,临床前GVL模型成为研究其机制和发现新治疗靶点的关键,因此构建一个高度临床相关的GVL模型显得尤为重要。
现有的GVL模型主要是通过将小鼠AML细胞移植到alloSCT的小鼠模型中来建立的,这些AML细胞来自体外培养的白血病细胞系或表达白血病驱动基因的小鼠骨髓细胞。使用这些模型的研究显著提高了我们对同种异体免疫的认识,但因为人类和小鼠之间的许多遗传和生物学特性存在差异,这类模型可能无法真实反映接受alloSCT患者的AML进程,因此在临床转化性研究的应用受到限制。而免疫系统人源化小鼠则为此类研究带来可能。
如何构建基于人源化小鼠的新型GVL模型
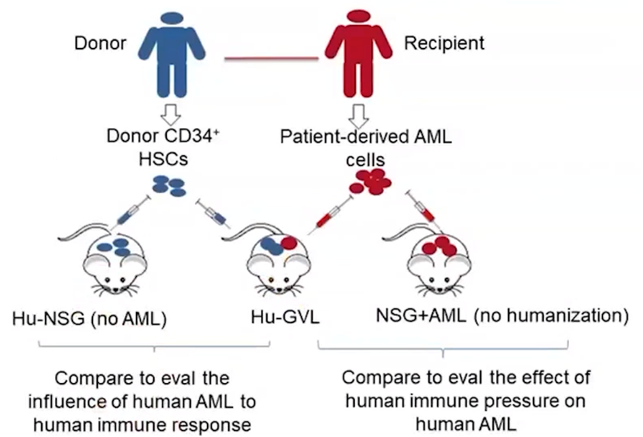
免疫系统人源化小鼠是此类转化性研究的理想平台。在近期发表的一篇文献中,研究人员在免疫系统人源化的小鼠中移植入患者的AML细胞,使供体免疫系统与患者AML之间发生相互作用,从而构建出新型的,更具临床相关性的GVL模型。
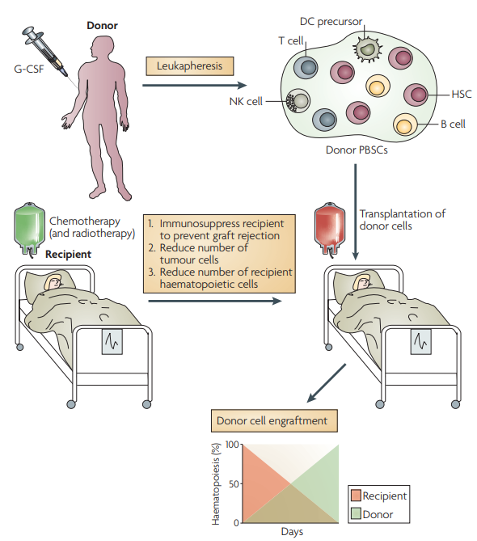
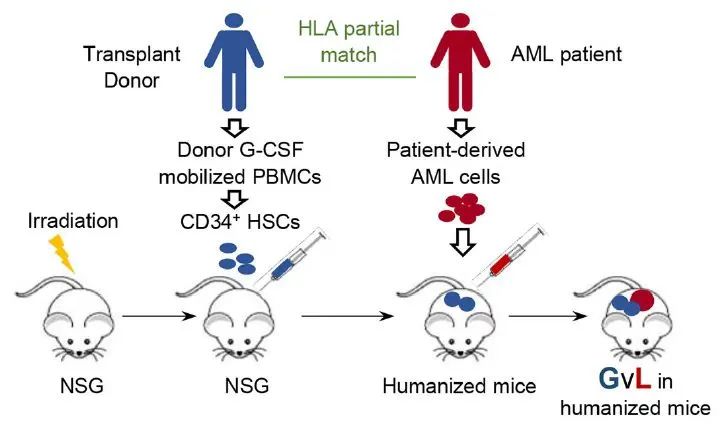
如下图所示,研究人员从供体外周血中纯化出造血干细胞,移植入NSG小鼠体内以建立人源化小鼠。在免疫系统重建后,再植入患者的AML,建立GVL模型。为了模拟临床alloSCT,研究人员选择了至少有一半HLA与HSC供体匹配的AML患者的白血病细胞。
源自脐带血和胎肝的HSCs常用于建立人源化小鼠,G-CSF动员的外周血由于其植入效率低而很少使用,然而却最广泛用于临床alloSCT。因此,用G-CSF动员的外周血构建模型,更能代表alloSCT的临床情况。
人源化小鼠GVL模型 具有高度的临床相关性
- hu-NSG小鼠的免疫重建过程与移植患者高度相似
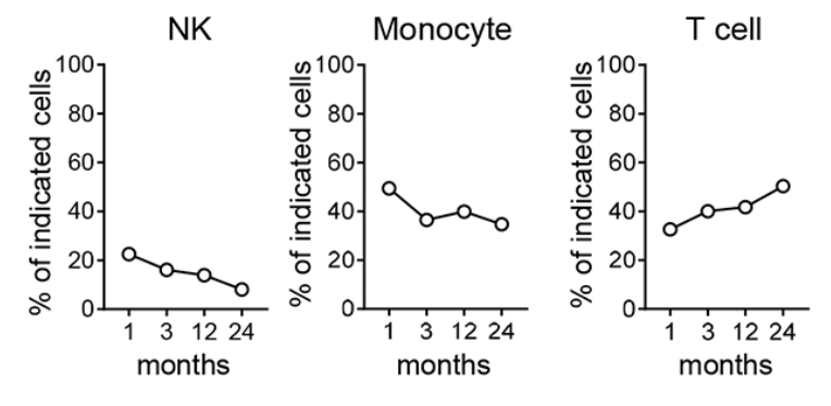
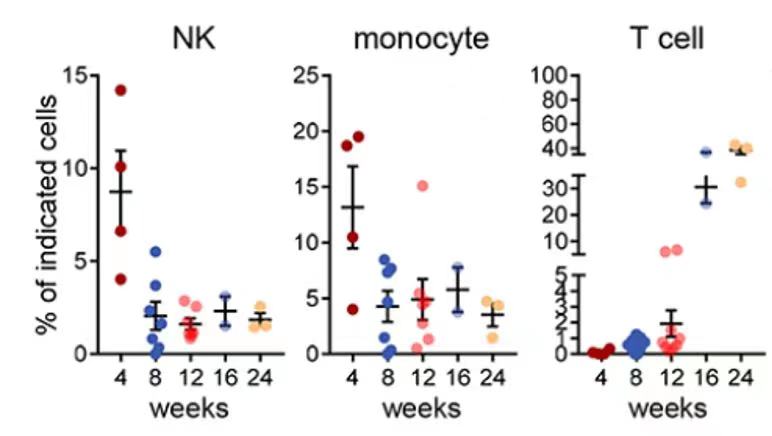
用于构建第一对hu-NSG模型的HSCs供体(pair 1),其PBMCs在此之前被alloSCT给一位AML患者,研究人员对该患者进行了临床随访,在移植后第1、3、12和24个月采集了血样,对其进行了全面的流式细胞术分析。发现患者体内供体来源的NK细胞、单核细胞、T细胞的变化趋势(如下图)以及T细胞的分化和功能状态,都与在hu-NSG小鼠中的观察结果较为一致。
在alloSCT后不同时间点,从接受了pair1 供体HSC移植的临床病人中收集系列血液样本,检测其中NK细胞, 单核细胞以及T细胞的比例
小鼠在接受HSC移植以后,对不同时间点的血液样本进行分析,检测其中NK细胞, 单核细胞以及T细胞的比例
2. 在hu-NSG小鼠中成功移植病人来源的AML
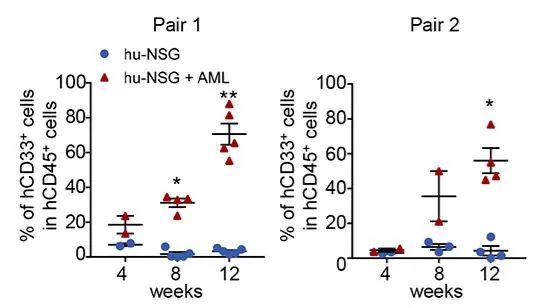
NSG小鼠在接受供体HSC注射12周后,研究人员将患者的AML细胞注射入小鼠股骨内。移植4周后,即可在血液中检测到表达CD33的白血病细胞,在12周时其含量上升到70%,并渗透至其他器官(骨髓、脾、肝脏、肺)。这些结果都与临床观察一致,表明患者来源的AML在hu-NSG小鼠中的成功植入。
在HSC移植以后第12周,移植入AML。在AML移植后的第4、8、12周检测外周血中CD33阳性的淋巴瘤细胞占比。
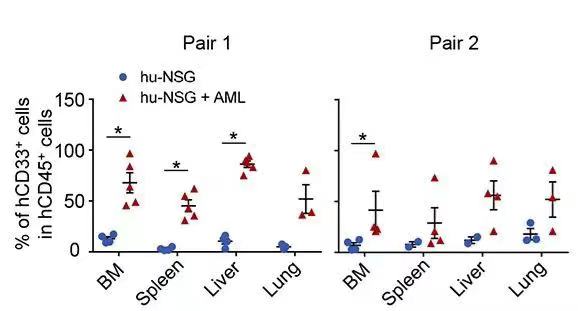 在HSC移植以后第12周,移植入AML。在AML移植后的第12周检测CD33阳性的淋巴瘤细胞在不同器官中的分布情况。
在HSC移植以后第12周,移植入AML。在AML移植后的第12周检测CD33阳性的淋巴瘤细胞在不同器官中的分布情况。
3. Hu-GVL小鼠模拟了alloSCT后AML复发患者白血球免疫逃逸的临床特征
在临床病例中发现,在alloSCT后复发的病人中常出现一些免疫抑制通路分子的上调,包括CD8 T细胞中PD-1和TIGIT,以及AML细胞中的PD-L1和CD155 (TIGHT配体)的高表达。
为了验证hu-GVL模型是否可以重现这些临床特征,该文章对比了hu-GVL模型和hu-NSG(未移植AML)小鼠的外周血中,CD8 阳性T细胞上免疫抑制通路分子的表达量。
结果表明,在AML移植后大部分时间点,hu-GVL小鼠中PD-1单阳性和PD-1/TIGIT双阳性的细胞占比更高。另外,研究者还检测了hu-GVL小鼠和移植了AML的NSG小鼠的骨髓细胞,结果发现在hu-GVL模型中,PD-L1和CD155 (TIGHT配体) 的表达量有显著升高,而HLA-DR的表达量则明显降低。这些数据均与临床病人上的情况一致。
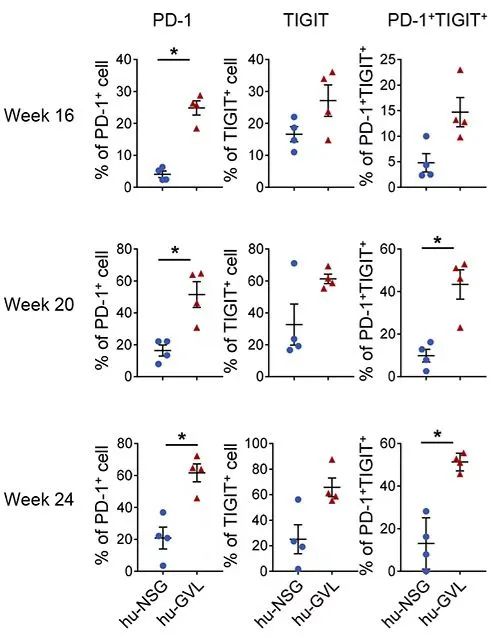
Hu-NSG和hu-GVL小鼠外周血中CD8 T细胞表面,PD-1阳性、TIGHT阳性以及PD-1/TIGHT双阳性细胞的比例。左侧时间表示HSC移植后的周数(AML在HSC移植后12周植入)
Hu-GVL模型的应用前景
▲ 由临床供体HSC和患者AML构建的hu-GVL 模型,具有高度的临床相关性,为确定患者的AML发病机制和发现新的个性化治疗奠定基础
▲ hu-GVL与alloSCT后AML复发的临床发现一致,即PD-1和TIGIT通路上调。因此,该模型为研究TIGIT联合PD-1阻断治疗AML的疗效提供了有价值的临床前平台
▲ hu-AML模型为研究人体免疫系统与AML的相互作用提供了极佳的平台
NSG™小鼠品系的免疫缺陷程度最高,是癌症跨物种移植、干细胞生物学、人源化小鼠、以及传染病研究的首选小鼠模型。JAX有多种NSG™小鼠模型,可满足不同的研究需求。
 在HSC移植以后第12周,移植入AML。在AML移植后的第12周检测CD33阳性的淋巴瘤细胞在不同器官中的分布情况。
在HSC移植以后第12周,移植入AML。在AML移植后的第12周检测CD33阳性的淋巴瘤细胞在不同器官中的分布情况。


