首次人体 (first in human, FIH) 临床试验的剂量选择,通常取决于综合评估试验药物疗效、毒性和稳定性的体外和体内研究数据。安全的给药方案,需要根据完整的临床前数据和类似化合物的历史信息来进行预测。
遗憾的是,抗体和多数生物制剂的临床前开发都面临着缺乏预测性体内模型的问题。这种分子的主要特征即特异性,意味着因缺乏相应的靶点它们几乎在所有非灵长类动物模型中没有活性。
目前,已获得监管机构认可的非人灵长类动物 (non-human primate, NHP) 种类极为缺乏[1],这对药物开发人员获取试验性新药申请所需的临床前药代动力学 (PK)、安全性和疗效数据,带来了巨大的难度。如果缺乏这些数据,同样将会给FIH临床研究给药方案的确定带来极大挑战[2]。
人源化小鼠是用于在药物临床前开发中识别人特异性靶点的新一代模型工具。过去几年,此类模型为临床前研究人员减少药物开发所需NHP的数量提供了多种选择性方案。
基因人源化小鼠模型用于预测基于Fc和白蛋白偶联实验药物在患者体内的血清
大多数循环大分子(包括抗体和白蛋白)的血清半衰期都受到内皮细胞的主动调节。这些循环蛋白会不断被血管内皮细胞内吞,在靶向作用下通过胞内溶酶体降解。
含有Fc的分子(如 IgG)和白蛋白会与新生儿Fc受体 (FcRn) 相结合,逃脱降解,并再次进入血液循环。由于抗体的Fc部分和白蛋白中的物种特异性序列介导着与FcRn的相互作用,因此无法使用经典小鼠或大鼠模型推测Fc或白蛋白融合药物的稳定性(图1a)。
为了解决该问题,来自杰克森实验室的Derry Roopenian教授与其他研究人员合作,通过将小鼠内源编码FcRn的基因替换为人源基因,构建了多种FcRn基因人源化小鼠模型[3](图1b)。
多年的验证性实验结果以及不同实验室发表的大量文章证实,这些模型中的Fc和白蛋白融合药物清除情况可反映药物在NHP和人体内的清除率。借助这些FcRn人源化小鼠模型,研究人员能够研究分子工程对候选药物稳定性的影响,并且可以预测药物在患者体内的血清半衰期。
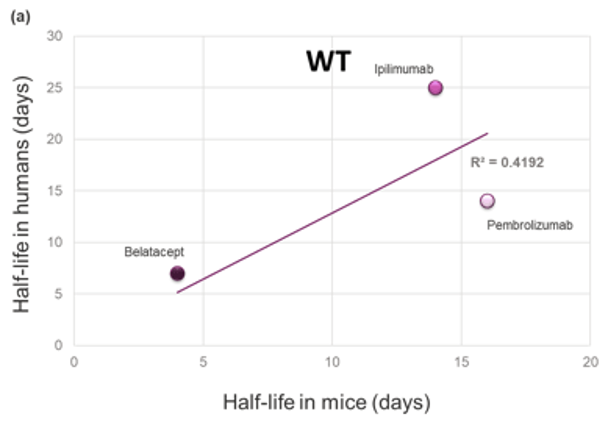
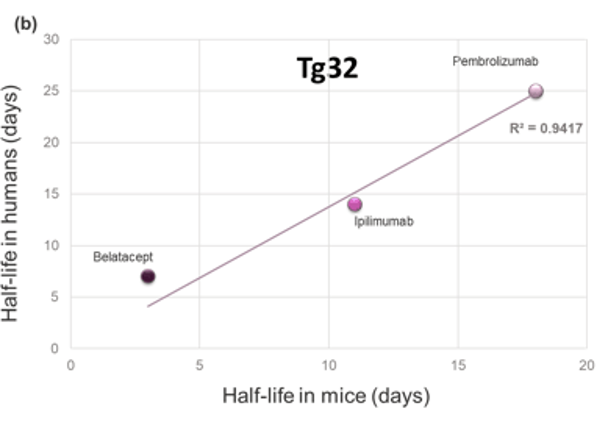
图1:三种治疗性抗体在a) WT小鼠体内或b) FcRn人源化 (Tg32) 小鼠体内的临床血清半衰期对比数据。线性回归模型的R平方如图所示,数据表明这些分子在人体内的PK与在FcRn人源化小鼠体内的PK之间存在很强的相关性,但与在WT小鼠体内的PK相关性差。
在大多数动物模型中,生物制品(如治疗性单克隆抗体)无法识别其靶点。由于缺乏相关体内模型,研究人员无法开展剂量反应试验,进而无法确定适当的临床治疗方案。在很多情况下,特别是联合免疫调节疗法,研究人员都在缺乏充分体内数据来确定安全、有效的起始剂量状态下将研究推进到临床阶段。
因此,临床研究人员只能根据历史数据来确定FIH研究的给药方案。当涉及创新型药物分子的时候,这一问题显得尤为棘手。此时通常需要根据最低预期生物效应水平 (minimal anticipated biological effect level, MABEL)采用繁琐的剂量递增方法,而MABEL却又是通过非理想的体外临床前试验计算得出的。即使有NHP数据可用,由于该类动物系统缺乏肿瘤特异性抗原,导致此类研究的转化相关性也较低,因此,鉴于缺乏安全给药信息,免疫激活生物制品的FIH临床研究存在固有的严重不良事件风险,例如,TGN1412[4],以及最近公布的Regeneron REGN1919双特异性抗体[5]。
植入人外周血单核细胞 (PBMC) 的重度免疫缺陷小鼠支持植入功能性免疫系统[6],并可用于研究免疫刺激药物的系统效应。重要的是,这种人源化小鼠支持体内植入人源肿瘤。通过这种方法,研究人员可以检测免疫激活分子介导的抗肿瘤反应,并能在人源肿瘤和人源免疫系统都存在的情况下评估这些药物分子的急性毒性作用(如CRS)。这种人源化系统的一个直接用途是评估免疫激活药物的潜在免疫毒性。CD28超激动剂TGN1412就是一个典型的例子,此药物在临床前试验中没有出现任何明显毒性,但在1期临床试验中却险些导致受试者死亡。
如图2所示,杰克森实验室使用PBMC人源化小鼠检测到TGN1412诱导的细胞因子释放以及由于不受控制的免疫系统激活而引起的器官毒性,证明了该系统的重要转化价值。由于反应与剂量相关,因此可以根据此数据确定人体临床试验的起始剂量。
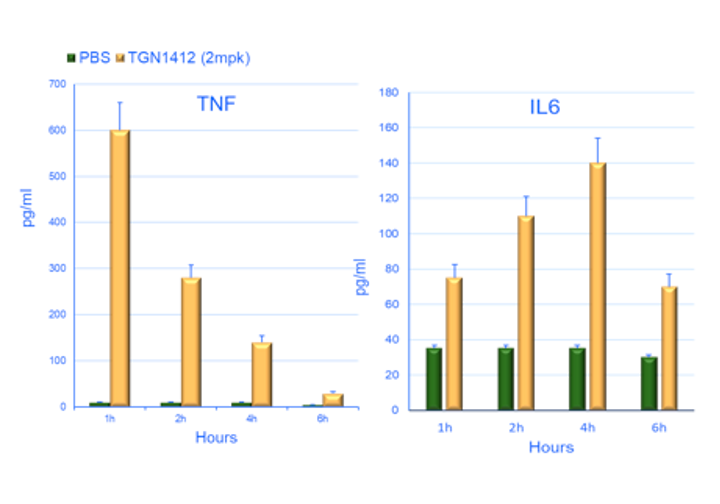
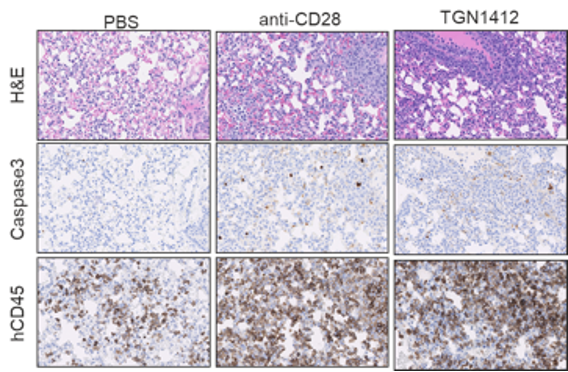
图2:使用CD28超激动剂TGN1412治疗PBMC人源化小鼠的效果。a) 和 b) 显示了两种促炎细胞因子的时程变化。条形图的上方标示了细胞因子名称。横轴表示接受药物治疗后的小时数,纵轴表示在接受治疗的动物血液中检测到的细胞因子浓度 (pg/mL)。绿色条形图对应于阴性对照组(注射对照药物)。右侧图片 (c) 显示了人源化小鼠接受对照药物 (PBS)、阳性对照药(CD28 抗体)和TGN1412治疗后10天的肺组织切片典型示例。图片左侧标记了染色方法。H&E(苏木精和伊红)染色显示存在许多组织浸润细胞。CD45染色证实浸润组织的细胞是人免疫细胞。Caspase 3染色显示组织中存在活性细胞凋亡。病理学分析证实TGN1412引起了组织损伤(未显示)。
这种更全面、更具潜在价值的实验方案,使得研究免疫激活生物制剂疗效和毒性成为可能。临床研究人员可以通过向PBMC人源化小鼠体内注射荧光素酶标记的肿瘤细胞,并使用不同浓度的候选药物治疗小鼠,从而绘制毒性和疗效的剂量反应曲线,确定安全、有效的FIH起始剂量(图3)。
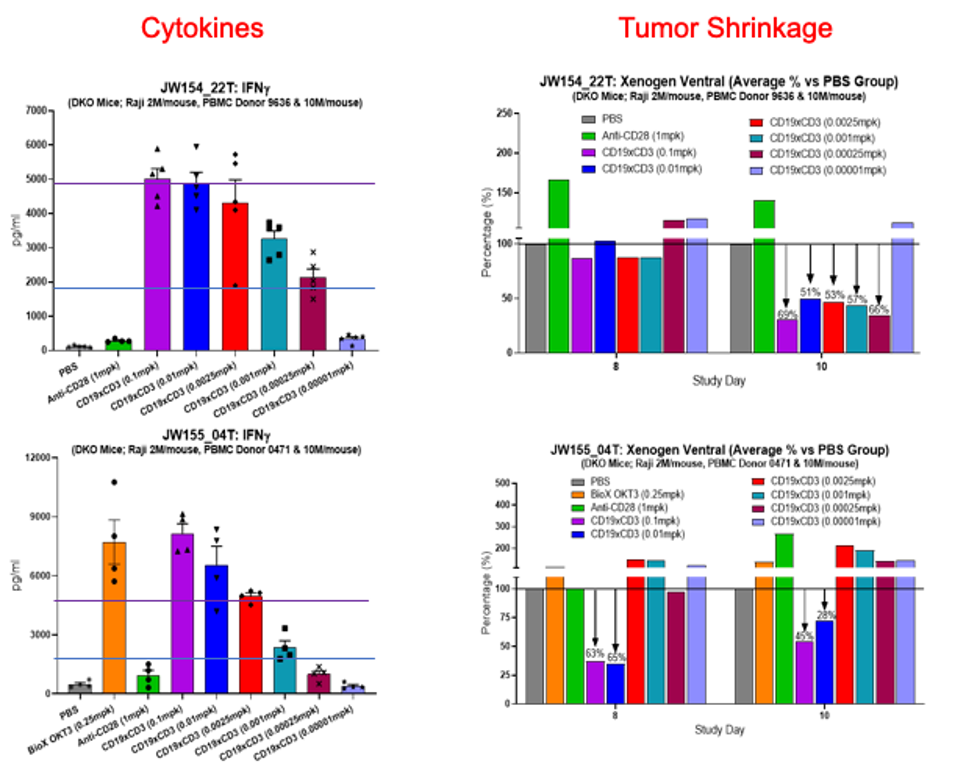
图3:植入来自不同供体PBMC人源化小鼠使用识别CD19和CD3的双特异性抗体后产生的抗肿瘤疗效和急性毒性反应。图表上方显示有检测和实验条件:a和c使用CD3衔接抗体治疗导致大量剂量依赖性细胞因子释放。横轴表示实验药物及其浓度。PBS为阴性对照药。CD28抗体和OKT3抗体分别是阳性对照药。b和d:残留发光(表示为在使用对照药治疗的小鼠体内观察到的残留发光的百分比)表明在使用药物治疗后8天和10天,荧光素酶标记的肿瘤细胞在小鼠体内的持久性。数字小于100%表示肿瘤生长受到抑制。如果毒性和疗效之间无线性相关性,则可以选择有疗效且无显著毒性的剂量。请注意,抗体对这两个供体的毒性/疗效不同,反映了临床患者个体反应多样性。
通过在同一个模型中进行简单的PK/生物利用度研究,并使用FcRn平台对同一药物分子数据进行整合(请参阅上一节),临床研究人员可以推测药物分子在患者体内的稳定性并能确定合理的给药方案。
大多数临床前研究的局限性在于,临床研究人员在向患者提供治疗时需要面临遗传多样性的问题。从实践角度来看,患者对同一种药物的反应相差极大——患者可能没有反应,也可能发生重度不良事件。PBMC人源化小鼠可以反映这种多样性。在利用来自不同供体的细胞和组织构建的人源化小鼠中,使用相同药物进行治疗可引起明显不同的反应,准确反映了临床真实反应(图4)。同样,该系统提供的这一重要信息还可帮助确定临床试验的起始剂量,确保即使是高反应者也不会面临发生重度不良事件的风险。
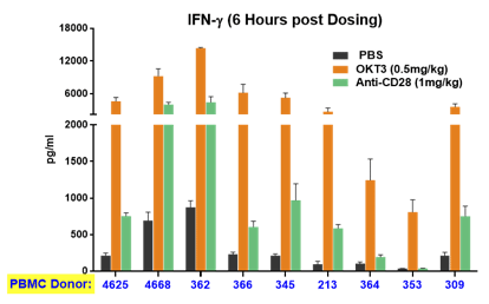
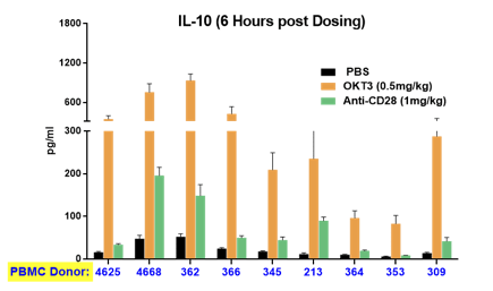
图4:免疫激活药物在植入来自不同供体PBMC的人源化小鼠体内引起的细胞因子释放反映了在临床上观察到的差异性。横轴表示不同的供体ID。上图和下图分别显示了INFγ和IL10的释放情况。不同颜色的条形图代表具体的治疗方法(见图注)。
目前,在确定抗体类药物FIH临床试验起始剂量方面,目前尚无较好的临床前方法。靶向抗原性质和候选药物剂型存在的巨大多样性,意味着在为剂量递增研究选择安全起始剂量方面仍然缺乏可靠的临床前或历史数据。因此,为能够让床前研究人员更有信心地预测临床研究的起始剂量,建议结合使用基因和免疫系统双人源化小鼠模型,使采用MABEL方法来研究预测。在今后的药物研发中,有望根据患者的PBMC预测他们对特定免疫激活药物的反应,从而为个性化治疗方案开辟道路。
参考资料:
[1] https://www.fda.gov/media/155950/download
[2] Saber et al., (2017). An FDA oncology analysis of CD3 bispecific constructs and first-in-human dose selection. Regul Toxicol Pharmacol ;90:144-152. doi: 10.1016/j.yrtph.2017.09.001
[3] Petkova et al.,(2006). Enhanced half-life of genetically engineered human IgG1 antibodies in a humanized FcRn mouse model: potential application in humorally mediated autoimmune disease. Int Immunol. 18(12):1759-69 doi: 10.1093/intimm/dxl110.
[4] Suntharalingam et al., (2006). Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 355(10):1018-28. doi: 10.1056/NEJMoa063842
[5] https://endpts.com/regeneons-star-bispecific-is-linked-to-2-deaths-in-a-small-study-which-was-no-help-for-its-q1-call
[6] King M, et al., (2007). Development of new-generation HU-PBMC-NOD/SCID mice to study human islet alloreactivity. Ann N Y Acad Sci. 1103:90-3. doi: 10.1196/annals.1394.011.

